Nat Comm | 斑马鱼模型重现VARS双等位基因突变引起的发育性脑病伴小头畸形

2019年2月12日,比利时鲁汶大学Peter de Witte课题组与安特卫普大学Peter De Jonghe课题组在Nature communications杂志上联合发表了名为 《Biallelic VARS variants cause developmental encephalopathy with microcephaly that is recapitulated in vars knockout zebrafish》的研究论文。该论文在10名发育性脑病伴小头畸形患者中筛选到了7个新的VARS基因突变,通过生物信息学分析结合体外实验指出这些变异是通过导致基因功能丧失而致病。作者在斑马鱼中准确地重现了这些变异引起的神经系统疾病的关键特征。这些结果为该类神经发育疾病的遗传学和生物学研究提供了依据,并为进一步研究氨酰-tRNA合成酶相关疾病和精准治疗铺平了道路。

在蛋白质翻译的早期步骤中,氨酰-tRNA合成酶催化特定氨基酸与其同源转运RNA(tRNA)的连接。VARS编码缬氨酸-tRNA合成酶,该研究通过国际合作或GeneMatcher计划共纳入了来自七个家庭的10例患者,所有患者都表现出全面发育迟缓和严重的智力障碍,达到行走年龄的9例患者中只有2例能够独立行走。8例患者出现癫痫发作,其中7例在新生儿或婴儿期发作(平均发作年龄6个月,中位数4.3个月)。其他临床特征包括肌张力低下(4例),痉挛(5例)和共济失调步态(2例)。脑部成像显示有8例患者出现脑萎缩,4例患者出现胼胝体萎缩或部分发育不全,4例患者出现髓鞘形成减少或髓鞘化延迟,所有患者均有严重的进行性小头畸形。
研究人员通过全外显子测序(WES)或全基因组测序(WGS)筛选到3个VARS基因的复合杂合突变:家系I (p.Leu434Val/p.Gly822Ser)、家系 II (p.Gln400Pro/p.Arg442Gln)、家系III (p.Leu78Argfs*35/p.Arg942Gln)先前的一项大队列研究报道了家系IV (p.Leu885Phe)和家系V (p.Arg1058Gln) 2个纯合错义突变以及家系VI和VII携带的纯合变异p.Arg404Trp。这些变异在ExAC和gnomAD中未收录或出现频率极低,对于上述错义变异,多种预测工具均预测变异有害,并且这些错义变异均位于蛋白质催化或反密码子结合结构域中(如图1所示)。
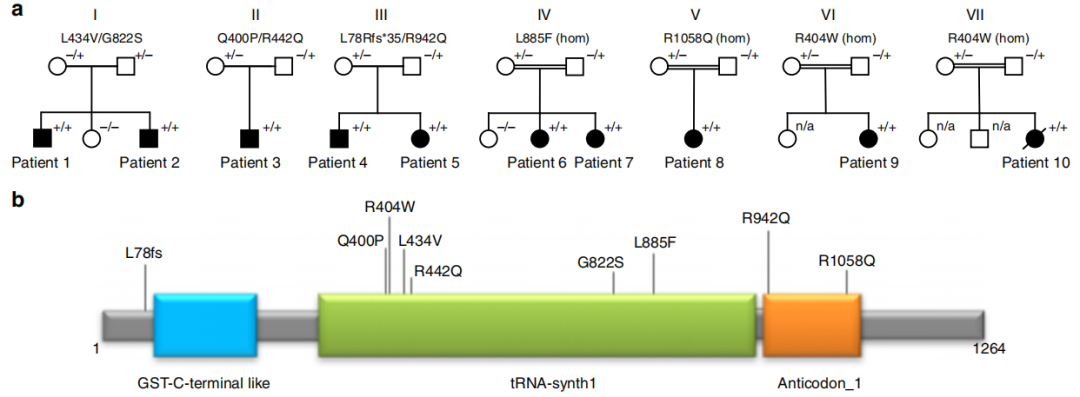
图1 VARS基因变异的家系图及突变位点分布
嗜热链球菌VARS蛋白及其相关tRNA复合体的晶体结构已被解析,因此作者将VARS蛋白序列与嗜热链球菌VARS蛋白序列进行比对以深入了解新筛选到的错义突变导致的蛋白结构变化及功能影响。比对发现,在筛选到的8个错义突变中,有7个可以对应到嗜热链球菌VARS序列相应的残基上,进而可以推断这些错义突变对蛋白质结构或底物相互作用的影响。经过分析,p.Gln400Pro, p.Arg404Trp, p.Leu434Val, p.Arg442Gln, p.Gly822Ser, p.Arg1058Gln这6个错义突变由于氨基酸的替换导致与附近一个或多个氨基酸残基相互作用的稳态失衡,因此可能对蛋白质结构有直接或间接的影响,但受p.Arg404Trp及p.Arg1058Gln这两个突变影响的残基与附近的其他残基没有特别强的相互作用,因此预测影响最弱。p.Arg942Gln 改变了该蛋白与tRNA底物的直接接触,因此可能会干扰tRNA的结合。作者又通过对VARS-tRNA复合体研究发现p.Leu885Phe变异可能影响酶与反密码子一个或多个官能团的直接接触(如图2所示)。
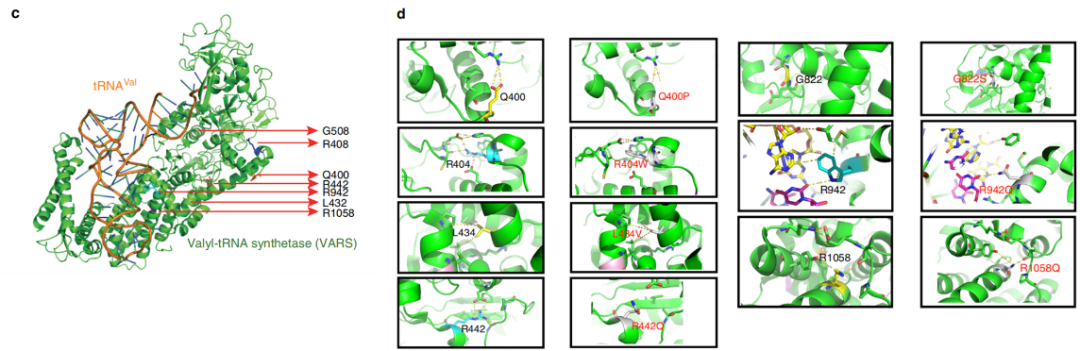
图2 VARS基因突变类型的蛋白结构预测
接下来,作者利用患者4、5(p.Leu78Argfs*35/p.Arg942Gln)的成纤维细胞研究了VARS突变后的功能变化。研究发现,与对照组相比,患者成纤维细胞中VARS蛋白显著降低,推测p.Leu78Argfs*35变异诱导了NMD从而导致蛋白表达降低(如图3 a所示)。免疫荧光染色结果表明,p.Arg942Gln变异不影响VARS蛋白在患者成纤维细胞中的定位(如图3 c所示)。作者又进一步检测了VARS蛋白的氨基酰化功能,发现来自患者成纤维细胞中的VARS蛋白活性显著降低(如图3 d所示)。利用家系I患者及亲本的淋巴母细胞系测定VARS基因的氨基酰化能力,结果显示携带p.Leu434Val / p.Gly822Ser变异的患者1和2,VARS氨基酰化程度相对于杂合子亲本降低了约50%,而携带p.Arg404Trp纯合变异的患者9表现出更大的VARS催化活性损失,仅为家系I亲本VARS氨基酰化程度的25%(如图3 f所示)。

图3 体外研究VARS突变的致病性
为了验证VARS基因突变在体内的潜在功能影响,作者使用CRISPR/cas9技术构建了斑马鱼vars基因敲除模型。RT-PCR检测到vars 纯合突变体mRNA的缺失,杂合突变体也缺失近一半mRNA(如图4b所示)。vars−/− 纯合突变体中由于vars的缺失,导致受精后8-12天(dpf) 的幼鱼过早死亡,这表明vars在斑马鱼生存中起到至关重要的作用。在触觉响应测试中,7 dpf 时35.3%的vars纯合突变体无触觉响应,且在6 dpf 88.2%的vars纯合突变体观察到异常的运动行为,比如痉挛运动(如图4d所示)。vars纯合突变体在形态上也观察到异常,最显著特征是小头畸形、部分前脑和口鼻部缺失、心包水肿等(如图4e所示)。作者利用1-5dpf 的斑马鱼前脑切片在组织学上进一步研究了这些畸形胚胎,发现2dpf 的vars纯合突变体中有细胞脱落,表明在发育早期存在有异常细胞凋亡的情况,使用caspase-3抗体检测结果显示在3-5dpf vars纯合突变体大脑中检测到了更多的凋亡细胞。随着发育进程,脑部结构异常不断发展:大脑结构破坏,下颌结构减少,视网膜分层延迟,晶状体减少,眼周肿胀(如图4f所示)。这些结果表明,vars的缺失会损害斑马鱼的头部和眼睛发育并对神经元的存活至关重要。
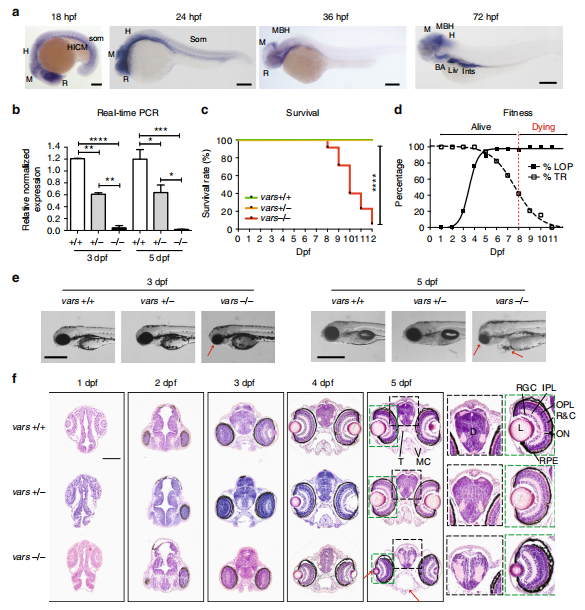
图4 vars纯合突变体表现出严重的发育表型和早期死亡
作者通过追踪运动轨迹研究斑马鱼行为学变化,发现vars纯合突变体游动能力显著降低(如图5a所示),使用明暗交替刺激对斑马鱼进行适应性测试,发现vars纯合突变体相较于对照组与vars杂合突变体更为活跃(如图5b所示)。为了研究vars基因敲除是否引起异常的大脑活动,作者采用电生理实验检测了斑马鱼的局部场电位,发现vars纯合突变体出现了类癫痫信号,并且vars纯合突变的幼鱼癫痫发作的比例显著高于对照组与vars杂合突变体(如图5c、d所示)。
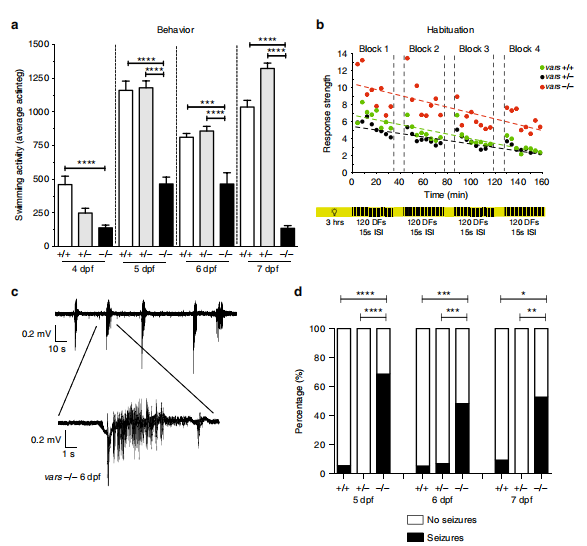
图5 vars纯合突变体表现出认知缺陷和自发性癫痫行为
接下来作者将野生型或突变的人类VARS基因注射到vars-/- 斑马鱼胚胎中进行挽救实验,发现野生型可以部分或全部拯救vars基因敲除引起的畸形(如图6a-f所示)。虽然p.Gln400Pro(位于催化结构域) 和p.Arg1058Gln(位于反密码子结合域)在蛋白模型分析预测中影响最弱,但是均无法拯救vars-/-斑马鱼的小头畸形和脑萎缩表型,p.Arg942Gln(位于反密码子结合域)仅部分挽救眼睛结构异常(如图6 g-i所示)。这一结果表明尽管这些突变对VARS蛋白结构和作用机制的预测影响不同,但在vars斑马鱼敲除模型的挽救测试中, 三个突变均显示出基因的功能丧失。
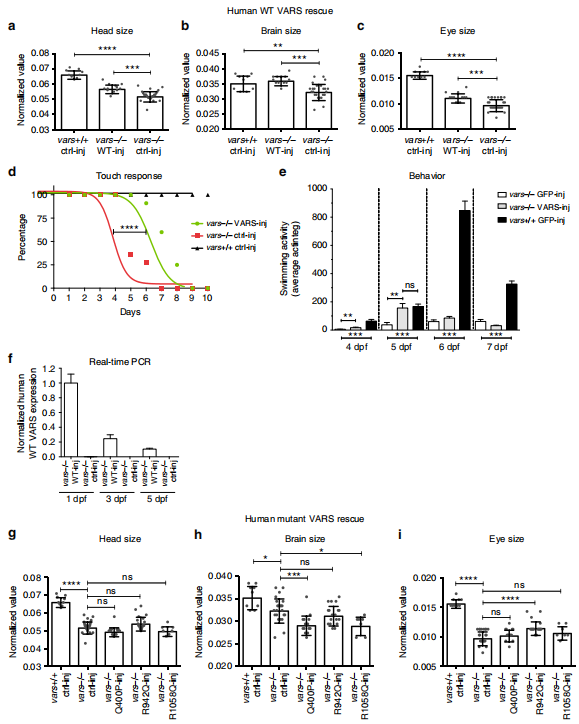
图6 野生型与VARS突变患者mRNA 的拯救实验
作者利用斑马鱼模型准确地重现了患者中所观察到的小头畸形及癫痫发作表型,并利用体外实验和斑马鱼表型挽救实验对VARS双等位基因多个突变的致病性进行一系列研究,指出VARS双等位基因突变的致病机理是基因功能丧失。本项工作中,斑马鱼提供了一个良好的模型系统用于测试多位点变异的遗传影响,并可作为药物筛选模型来寻找针对这类严重疾病的精准治疗方法。
赛福基因现已开展“功能验证”服务,欢迎添加客服微信了解详情。
![]() 微信扫描/长按识别二维码:
微信扫描/长按识别二维码:



