全外显子测序在遗传病临床诊断中的应用
全外显子测序是目前遗传病基因检测市场中最炙手可热的检测项目,可以说没有之一。全外显子测序自2017年左右开始应用于临床,短短两年时间,已现身于各个行业大会,并且深得部分大牛的青睐。

图片来源:google
本文将从临床应用的角度向大家剖析全外显子测序的价值。
基本概念
图片来源:《医学遗传学》
外显子(exon)通常是指基因内的DNA编码序列,并且最终表达为蛋白质。外显子组是指物种基因组中所有外显子区域的总和。人类外显子组包括22,000余个基因,共180,000余个外显子。整个外显子区域长度只有全基因组的1-2%【2】,但是却涵盖了大多数的单基因病致病突变【3】。
经济角度
临床上大多使用panel的角度,是希望患者花最少的钱找到病因。panel价格比较友好,一般都在4000元以下,且包含了几十到五千个不等的基因,所以NGS在临床应用的初期,panel一度是主流检测产品。
其实早在2014年,行业大牛Illumina推出了HiSeq X Ten,每台HiSeq X仪器3天可产生1.8Tb的数据,若同时运行10台仪器,人们每年可测序>18,000个人类基因组。这一仪器的推出使得测序成本大幅度下降,也使得传统panel测序的优势不再明显。
现在各家公司推出的WES,单人均价在7000元左右,家系10000元左右,检测的却是20000+基因;而传统panel,例如一度盛行的医学外显子,最多检测5000余个基因,市场价位也要在4000元左右。平摊到单个基因,传统panel是WES的单个基因检测成本的至少四倍多。
检出率角度
在一些临床异质性(同一基因引起不同的临床表型)和基因异质性(同一临床表型可以有不同的基因突变引起)极强的疾病中,如癫痫、智力障碍等,WES检测相较于传统panel检测的优势更为突出。
今年五月份刚发表在Genetics in Medicine上的一篇文章通过对PubMed上所有关于NDDs 基因检测的文章进行meta分析后,得出外显子测序是检测NDDs 的第一线方法【4】。
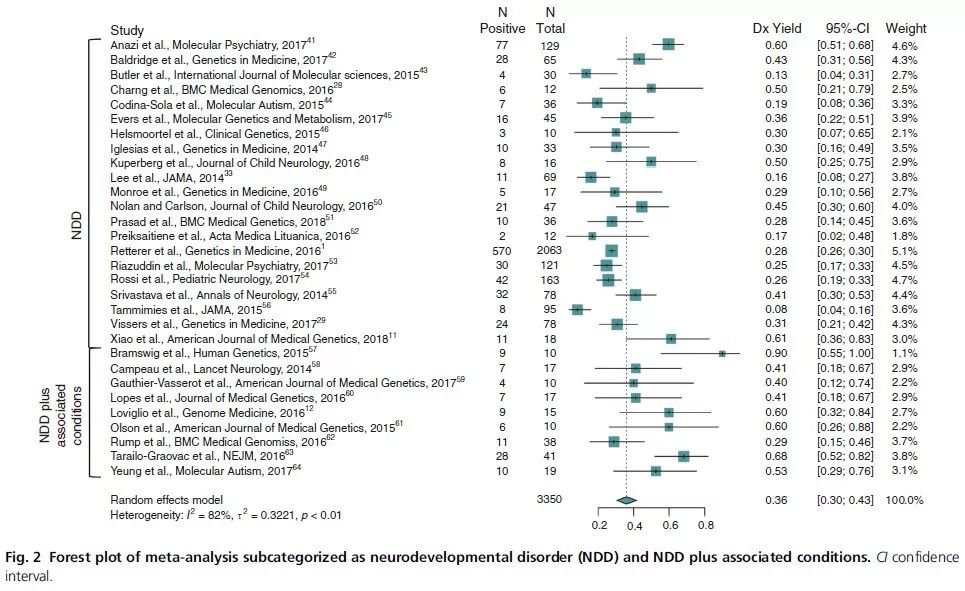
图片来源:Genetics in Medicine
从这些文献中,作者得出,对于NDDs 这种异质性极强的疾病,外显子检测比CMA这类检测方式的检出率更高(CMA的检出率15-20%;WES的检出率30-43%)。

图片来源:Genetics in Medicine
去年,Dillon等人发表在European Journal of Human Genetcis上的一篇文章【5】,对145名WEST综合征入组患儿的检测项目以及相关花费进行对比,最终得出,WES是目前性价比最高的检测方法。
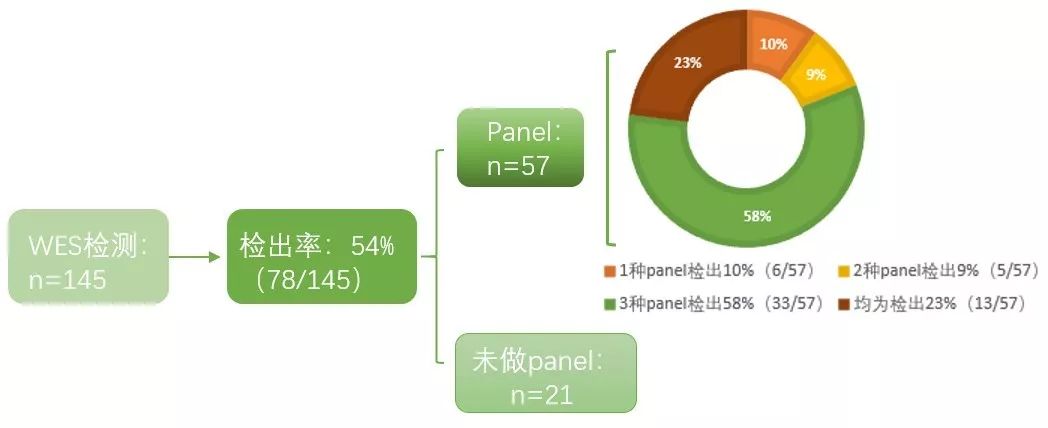
图片来源:European Journal of Human Genetcis
从上图中可以看出,相较于尝试多个panel才能检出真正病因的方式,直接在首次即进行WES的检测才是最经济实惠并且患者高度受益的检测方案。
另外,见下图,Wright等人于去年发表在Nature Genetics上的一篇review中的配图【6】。
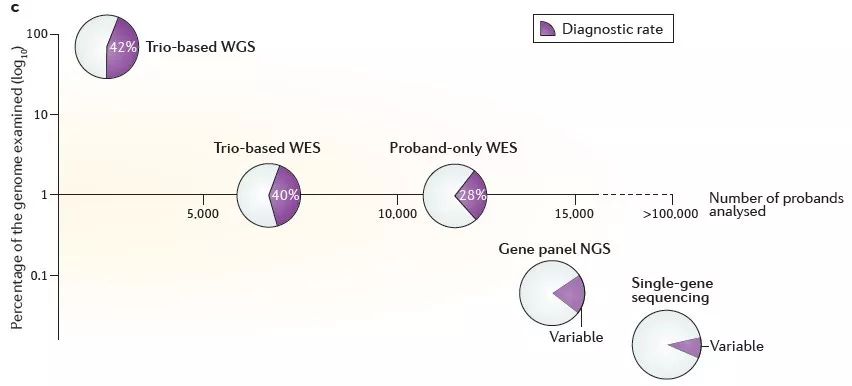
图片来源:Nature Genetics
文中作者强调,选择测序产品的诊断潜力与其实用性和成本之间存在着平衡。从上图中可以看到,家系WGS具有最高检出率,也是信息量最大成本最高的方法。鉴于大多数目前已知的致病突变位于基因组的编码部分,使用家系WES虽然略微降低了检出率,但却大大降低了成本。
数据价值
遗传病检测市场上总能听到这样的说法:患者没必要做WES,因为目前已知的只有5000余个基因与疾病相关,为什么要患者花额外的钱去检测那些尚不明确的基因呢?
这个说法在某种程度上得到很多人赞同,那为什么还要推WES呢?因为数据带来的价值远高于其它NGS产品。患者做了WES之后,除非是动态突变或者内含子区域的变异,其它位于外显子区域的点突变或小的缺失重复均可以通过疾病数据库的更新进行病因的再分析。一个panel,无论是小panel还是医学外显子,本质上还是富集了指定基因的序列数据信息。随着科学水平的进步以及新的致病基因的发现,这些panel在数据价值和再分析水平的表现都没有WES的数据优秀,甚至可以说它们没有任何再分析的价值。
下面就用真实案例来说明WES的数据价值。
案例一
8月余女性患儿因疑诊遗传代谢病和发育迟缓申请进行WES检测,2018年7月2日进行采样,2018年7月24日出了第一份检测报告,当时是一份阴性报告,该患儿并未检出可以明确解释患者表型的致病性或疑似致病性变异。
而后,于今年的2月13日,经过基因检测公司后台的一些WES数据重分析,找到了致病原因。

图片来源:赛福基因检测报告
那为什么之前没有检出呢?
其实之前也有检出,但由于当时OMIM中关于CACNA1E 基因,并无任何疾病与之关联,解读人员将这个变异放到了基因检测报告表二的提示表格中。

图片来源:赛福基因检测报告
无独有偶,另一位患儿的样本也是同样的情况。
9个月女性患儿因癫痫和发育迟缓申请进行WES检测,于2018年1月12日进行采样,2018年2月8日出了第一份基因检测报告,也是一份阴性报告,该患儿并未检出可以明确解释患者表型的致病性或疑似致病性变异。
随后今年的2月13日,经过基因检测公司后台的一些WES数据重分析后,给患儿找到了致病原因。
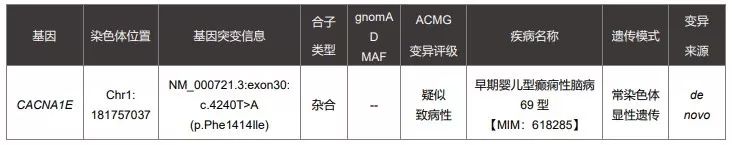
图片来源:赛福基因检测报告
同样由于当时OMIM中关于CACNA1E 基因并无任何疾病与之关联,解读人员将这个变异放到了表二的提示表格中。
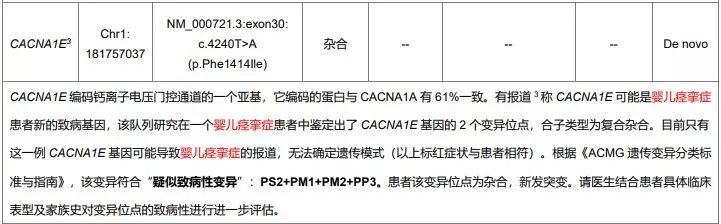
图片来源:赛福基因检测报告
最后再去OMIM中看看CACNA1E 的词条收录日期。

图片来源:OMIM
这个疾病相关的词条就是今年年初才更新的,因此,更新之前无法真正明确该基因的致病性也在情理之中。
如果患儿当时做的是癫痫panel或者医学外显子之类的产品,想要再次明确病因只能再抽血进行更新基因包后的panel检测,并且还存在二次检测费用及二次抽血。
案例二
第二个案例,患者在A基因检测公司做了癫痫panel,检测报告为阴性。医生经科研项目于2018年8月将全外的fastq数据给到B公司重分析,2018年9月14日,再分析结果仍为阴性。今年年初,患儿再去临床医生处复诊,B公司又重新给患儿分析了一次,这一次检出了致病变异。
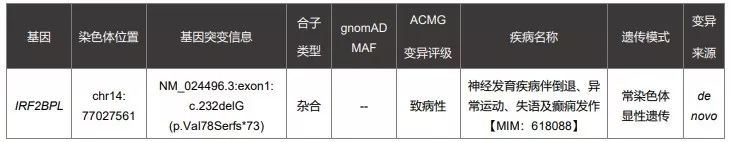
图片来源:赛福基因检测报告
再来看看这个疾病在OMIM中的收录日期:

图片来源:OMIM
该疾病早在2008年就出现了,但是去年的12月才更新了明确致病基因,今年的4月份又更新了一次。
因此,无论是在哪家公司做的WES,只要数据质量合乎标准,它的再分析价值就一直能体现。相对于传统的panel,捕获的永远是已知的致病基因,随着数据库的更新,患者如果想要继续确诊又需要再做更新版本的panel,滞后性一直存在。现在的全外价格全面下降,为何不多花两千余元省去后续再补做panel的风险呢?
局限性
刚刚说了那么多WES的优点,那么是不是WES就是万能的呢?
答案是否定的,某些特殊类型的突变,如动态突变(脆X综合征)、存在高度同源性的假基因的疾病(先天性肾上腺皮质增生)以及某些突变类型以缺失重复为主的疾病(DMD)这些还是需要特定的检测手段进行检测。
临床医生如果碰到以上突变类型为主的疾病,需要留意送检的检测类型,避免假阴性结果的产生。
小结
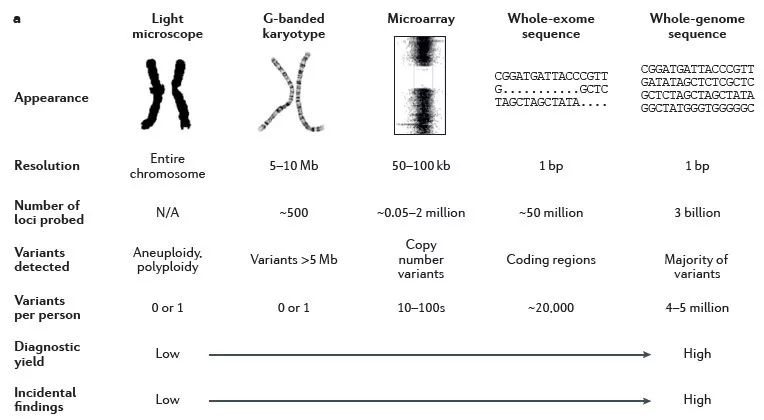
图片来源:European Journalof HumanGenetics
从分辨率最低的核型分析到现在可以精确到单个碱基变化的NGS测序,不同的检测方法都有其对应的应用场景、检测范围和局限性,不同的检测方法亦有其存在的合理性。由于各大开源数据库的不断更新以及世界各地医疗科研工作者的努力,在均衡性价比的情况下,一次性尽可能检测更多的信息肯定让患者受益更多,因此WES的优势就愈加突出。
技术革新总会带来新的疾病认知,从21三体综合征、CNV导致的Williams综合征到如今单点突变导致的各种疾病等等,技术带来的检测范围在不断扩增,应用WES测序是大趋势,panel的更新永远跟不上数据库的更新。
当然最近WGS也非常火热,但是各家公司WGS的检测价格仍然非常高昂,相应的算法尚未匹配,相信在不久的将来,WGS也会取代WES,这就是技术发展的驱动力吧!
参考文献:
1、《医学遗传学》邬玲仟,张学主编. —北京:人民卫生出版社,2016
2、Alison M. M., Morad A., David R F., Martin S. T., Variant detection sensitivity and biases in whole genome and exome sequencing.,BMC Bioinfomatics 2014, 15:247.
3、Cooper DN, Krawczak M, Antonarakis S. In The Metabolic and Molecular Bases of Inherited Disease. 7th edn. 1995:259-291.
4、Siddharth S., et al., Meta-ananlysis and multidisciplinary consensus statement: exome sequencing is a first-tier clinical diagnostic test for individuals with neurodevelopmental disorders., Genetics in Medicine, 2019.
5、Dillon, O. J., Lunke, S., Stark, Z., Yeung, A., Thorne, N., ... Tan, T.Y. (2018). Exome sequencing has higher diagnostic yield compared to simulated disease‐specific panels in children with suspected monogenic disorders. European Journal of HumanGenetics, 26(5), 644–651.
6、Wright C.F., FitzPatrick D.R., Firth H.V. Paediatric genomics: diagnosing rare disease in children. Nat. Rev. Genet. 2018; 19:253–268.


