赛福基因公开课《浅谈罕见病市场前景及研发策略》
Part-1
嘉宾介绍
巩克瑞,临床医学学士学位,神经生物学博士学位。于2012-2016年在旧金山加州大学(UCSF)进行博士后研究并晋升为助理研究员,方向为慢性疼痛的发病机理以及其潜在的治疗靶点。目前在一家专注于罕见病研发的生物企业的转化生物部门做研究科学家并在UCSF做兼职顾问。个人擅长技术为动物模型的创建,药物在体筛选以及采用电生理、行为学以及其它方法进行疗效评估。兴趣在于:发现新的药物靶点,探讨新的治疗策略,以及发现和利用新的生物标记物对疾病和疗效进行评估。
Part-2
公开课环节

各位群里的老师朋友们,大家好,我是克瑞,现就职于博鳌万里生物科技有限公司。目前主要从事罕见病以及疼痛方面的研究。 首先,非常感谢主办方cipher基因提供这样一个和大家交流的机会。

这是我的个人声明。

在今天的报告中,我主要讲三个方面。第一个方面是罕见病的概述,第二是罕见病的治疗药物,也就是俗称孤儿药的市场情况,第三我想结合自身在罕见病药物开发方面的经验, 和大家探讨一下罕见病的研发策略。在研发策略中,我会侧重于酶替代疗法的药物开发,并以我们公司去年刚刚批准的药物为例来介绍罕见病药物的前期开发过程。

首先我们来看第一部分罕见病的概述。

罕见病这个概念估计最近大家都不陌生,其也称之为罕见疾病,是指仅在极少数人身上发生的稀罕病症。因为发生人数少,所以也统称为孤儿病。关于罕见病的定义,各个机构或者国家给的定义均不相同,而且差异比较大。比如WTO规定只要患病人数占总人口的0.65‰-1‰之间的疾病就可以定义为罕见病,而在欧盟一般认为患病率低于1/2000的疾病为罕见病,美国是规定在20万人以内,而日本是规定少于5万,我国台湾省的规定是患病率低于万分之一。我国最近也给出了建议:成人患病率低于50万分之一,在新生儿中的发病率低于万分之一,称之为罕见遗传病。
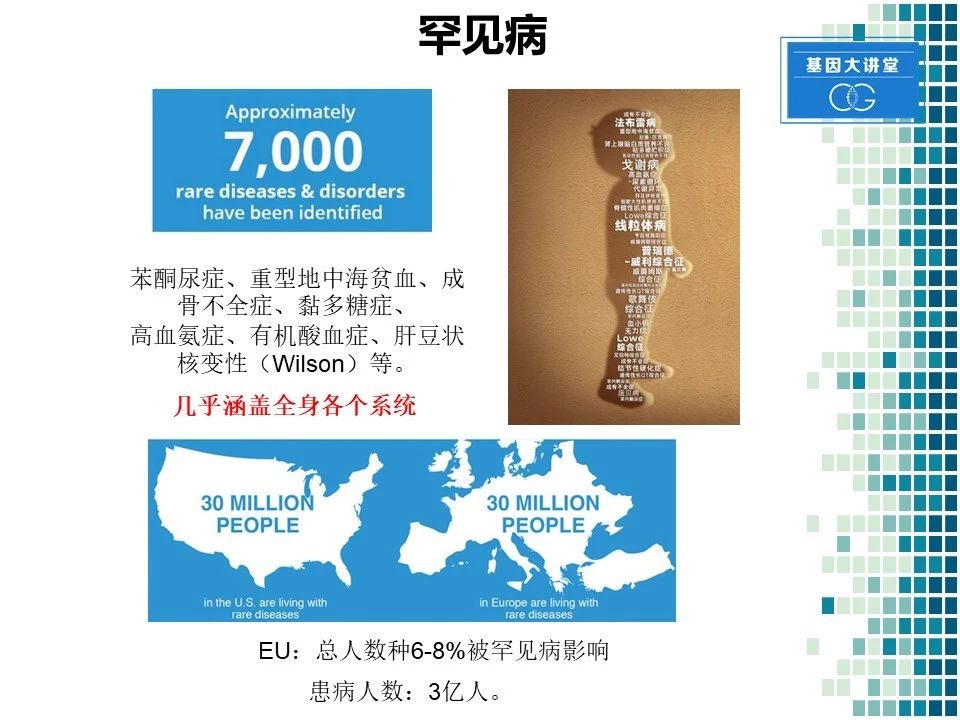
据统计,目前已知的罕见病大约有7000多种。罕见病这个概念大家虽然不陌生,但日常接诊过程中,可能碰到的患者并不多。大家可能听说过的罕见病的名称,比如苯丙酮尿症,重型地中海贫血以及肝度、肝豆状核变性等。就患病人数来讲,估计在美国有3000万人患有罕见病,在整个欧洲,差不多也有3000万人,全世界的患病人数可能在3亿左右。

罕见病不同于常见病,有其自身的特点。1.多为遗传性疾病,2.正因为是遗传病,所以它有明显的人种差异。比如囊性纤维化以欧洲人多发,而在肝豆状核变性中,以亚洲人群居多。发病人数也相差很大,其中核酸五磷酸异构酶缺乏病,目前认为是最为罕见的遗传病,自从第一例发现到现在,距27年的时间,仅仅发现了三例患者。3.罕见病的特点是其多发于儿童。在出生后一年死亡的儿童中,35%的原因是由罕见病引发。在整个罕见病的患病人群中,有50%的人是儿童。

下面我们再来看一下罕见病的治疗状况。目前差不多有450种已经获批的罕见病药物,但相对于7000多种的疾病数目来讲,450种疗法显然是杯水车薪。所以总体罕见病的治疗,还处于缺医少药的境况。也正是因为这个原因,各地方成立了很多机构,以推动罕见病药物的研发。国际罕见病组织将每年2月份的最后一天,定为世界罕见病日。各国最近也推行了一些法案来促进罕见病药物的开发,美国国会就通过一项法案从政策上进行罕见病药物开发的扶持。我国于今年各个部委联合公布了第一批罕见病目录。但值得注意的是,我国在2018年才开始公布,中间整整落后了35年的时间,所以对我们国家来讲罕见病的研发还急需促进。
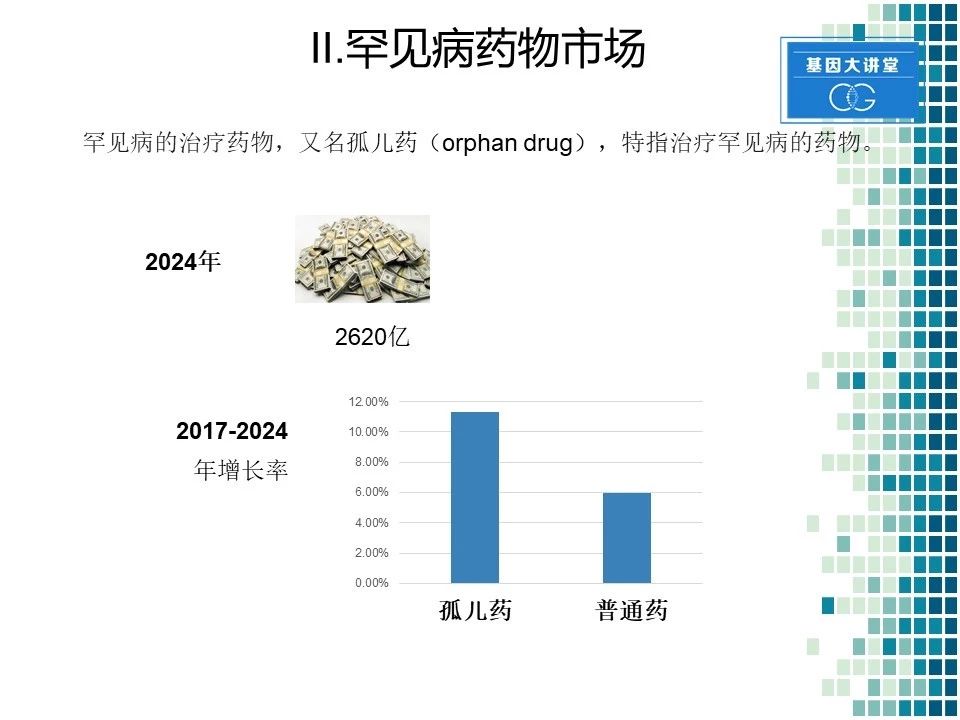
下面我们讲第二部分,罕见病的药物市场。罕见病的治疗药物,大家通俗称之为孤儿药。据估计到2024年,全球的罕见病药物市场会达到2620亿左右。而且在2017年到2024年的7年时间里,据测算罕见病孤儿药的市场增长率会在大约12%左右,而普通药物,其增长率在6%左右。由此可见,孤儿药市场潜力还是很大的。
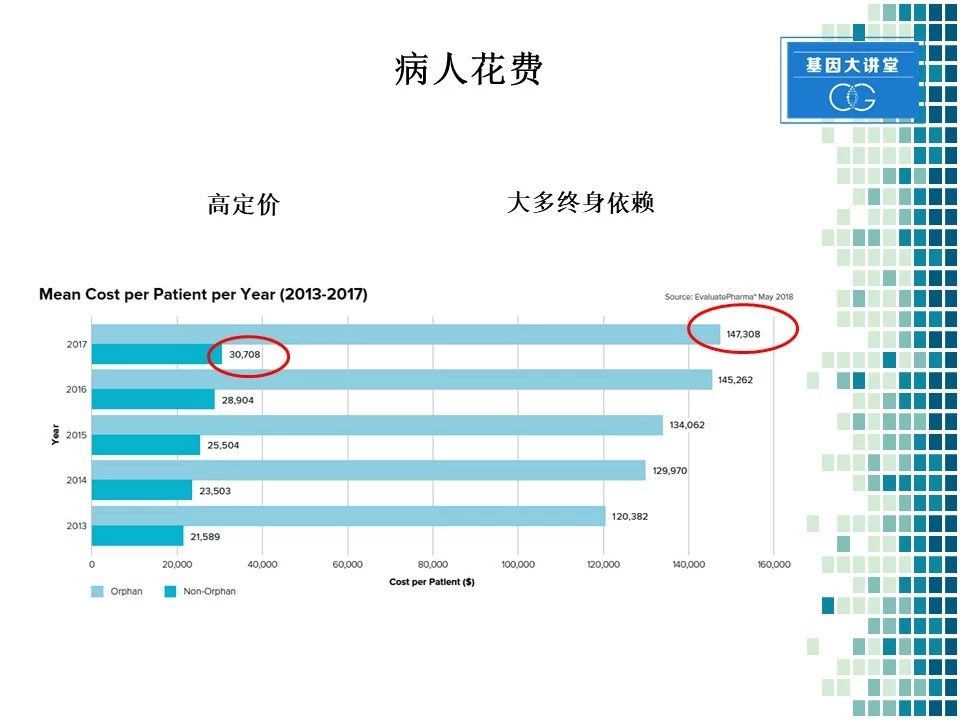
对于罕见病病人来讲,其药物花费也是比较高的。因为相应的用药人群少,所以罕见病药物的定价都比较高。另一个特点,罕见病病人大多数需要终生服药。这两种情况就决定了病人的花费非常高。从这图表你就可以看到,对于非罕见病来讲,美国患者每年的花费在大约在3万美元左右,而对于罕见病患者,其每年的花费在14万美元左右。

孤儿药的研发有很多独特的优势。首先,罕见病的靶点都比较明确,这样就决定了其研制的周期比较短。其次,由于罕见病病人比较少,所以临床的实验规模也会比较小。它的研发成本会相对降低。大家都知道新药的研发、临床实验,其实会占整个新药研发开销的60%到70%左右。FDA允许罕见病的临床试验中,病人的数量在十个病人左右,所以这就决定了孤儿药临床试验的花费比较小。另一方面,世界各国对罕见病的研发也有一些政策支持。比如在这里以美国为例讲一下FDA的政策扶持。 首先, FDA允许罕见病研发公司向本机构寻求特别协助,而且能在药物申请上市过程中进行快速审批,并免除申请费用。同时,政府会向孤儿药提供开发补助,或者说研究基金在每年的额度为3000万美元左右,另外美国还给予孤儿药特殊的税费政策,也就是说临床实验费用的50%是可以抵减税额。同时,绝大多数国家都给予孤儿药市场专有权,比方说在美国17年,而在欧盟的是10年。

我们再来介绍一下孤儿药的获批情况。由于各个国家的政策支持,孤儿药的申请在近年来取得了长足进展。通过这张图表我们可以看到,在1983年,仅有两例孤儿药的批准。到去年2017年,共有77个孤儿药或者孤儿药的适应症获批,中间发生了巨大的变化。同时我们再来看另一组数字,在1983年美国孤儿药法案通过之前,总共只有38个药物用于罕见病的治疗。而到目前为止,已经有496个药物用于罕见病的治疗。我们来看一下最近两年的数据,从中也可以看出一些变化。在2017年,在FDA批准的47个药物当中,有39%的药为孤儿药。而在2018年,目前为止批准的17个药里面有8个药物是孤儿药,占47%。

现在,重点讲一下孤儿药的研发,并结合我的个人经验,和大家来探讨一下孤儿药的研发过程,希望能给大家有一定的借鉴作用,起到抛砖引玉的效果。

在研究疾病之前,我们需要了解这个疾病的病因。就像我们前面所提到的,罕见病通常都是遗传慢性疾病,而且80%的罕见病被认为有遗传因素,当然也有一部分还没有发现明确的致病原因。遗传性疾病我们都知道可以大体分为三种:常染色体遗传、性染色体遗传和线粒体遗传。在常染色体遗传中又分为显性遗传、隐性遗传和突变型。由于这是基本知识,此处就不做详细解释。

现在我们来介绍一下罕见病病种的选择。就像前面介绍的,罕见病总共有7000多种,那么我们应该选取什么样的罕见病来作研究呢?我个人认为罕见病的选择应该从以下几个方面来考虑。首先第一个问题是病人的人数问题,如果某病的病人人数过少其市场太小,研发的阻力也比较大。毕竟药厂要追求利润,如果市场过小是没有利润的。一般认为,5000左右的病人数目是孤儿药研究的分水岭,高于5000的罕见病人的罕见病是值得研究的。第二个问题就是罕见病的治疗时间窗的问题,如果治疗时间窗过短,或者说发病太急,那么相对来讲用药时间就比较短,病人也会比较少,这样的罕见病研发起来就比较困难了。既然提到了治疗时间,另一个决定性的因素,就是诊断的方法和诊断时间,某个疾病诊断的时间越早,我们治疗的时间窗就会越长。如果某个疾病三个条件都满足,那应该如何进一步选择呢?我认为还要考虑以下几个原因。第一,选择单一基因的疾病,其致病原因比较明确,相应来讲,药物的作用位点也就会比较明确,而且一般来讲,单一基金通常只会编码一个致病蛋白,这样相应的靶点就很明确了。
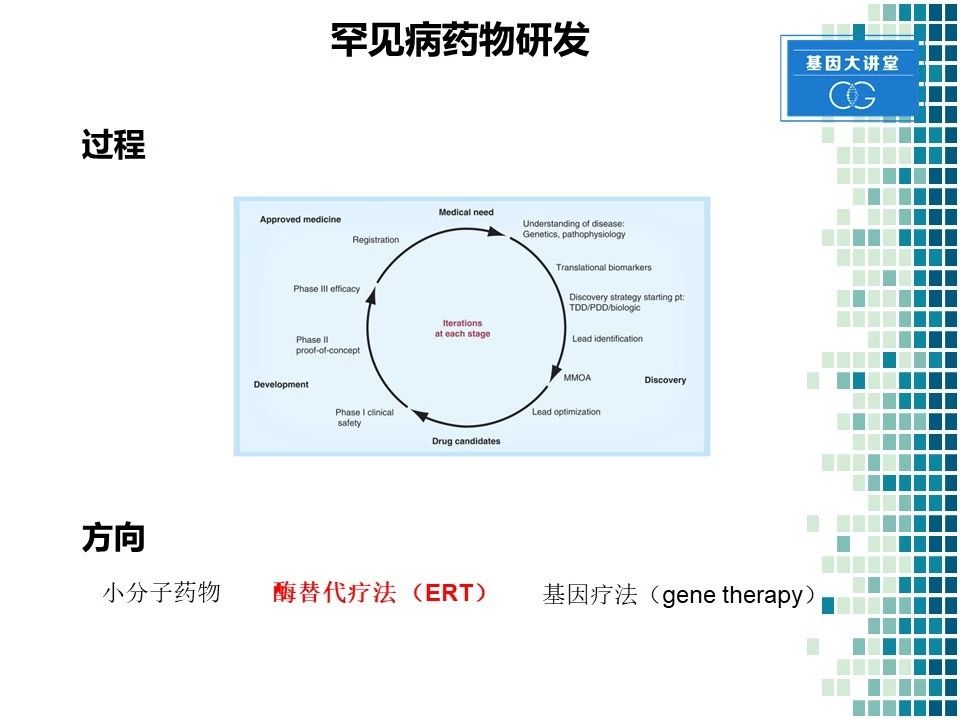
我们再来看一下常见的药物研发流程。首先,我们需要论证某种疾病或是某种药物具有一定的市场,紧接着我们要对这些疾病进行前期的研究,要了解它的遗传学以及病理学过程。同时,我们要确保这类疾病有一定的可研究的生物标记物。这样我们就可以从细胞水平上进行药物的初级筛选。筛选之后通过动物模型,进行进一步的验证和优化。最终,我们进行一期、二期、三期临床实验,最终进行新药的注册以及申请上市。对于罕见病来讲,主要有以下几种方向,第一种是小分子药物,第二种是酶替代疗法,第三种是基因疗法。对于我们公司来讲,目前获批的七个药物当中,都是酶替代药物,所以我们就侧重讲一下酶替代疗法。

在讲酶替代疗法之前,我们首先来看一下小分子药物。小分子药物主要是通过一系列的筛选,选出化合物。这里的小分子相对于生物制剂来讲,因为生物制剂大部分都是蛋白质或者多肽,是分子量比较大的物质。小分子化合物针对的病症主要是一些罕见的癌症,或者其它的相关疾病。最近最有名的例子是格列卫,也就说甲磺酸伊马替尼片,它主要是应用于费城染色体阳性的慢性髓性白血病。如果大家去注意一下这个药物的研发过程,你就会发现这个药物主要经过四个过程:第一,高通量药物筛选。第二细胞学实验。 第三动物实验,最后推向临床进行病人的疗效评估。

下面就开始讲,酶替代疗法的药物研发。这种疗法主要是针对患者体内缺乏特定酶的时候进行治疗。目前研究最主要的疾病是溶酶体贮积症的治疗,比如戈谢病、粘多糖累积症和法布里病。我今天以Bineura为例,讲述这个药的前期研发过程。这个药于2017年获批为孤儿药,应用于婴儿型神经元蜡样脂褐质沉积症,也就CLN2的治疗。在下面的讲述中关于这个疾病,我们都简称为CLN2。对于这个药物的研发过程与小分子药物的研发过程类似,但首先我们不是进行了小分子药物的筛选,而通过酶的合成。随后经过细胞实验,主要是验证这个酶的摂取情况以及初步疗效。随后我们又采用了一系列的动物模型,从小鼠到犬一直到猴均进行了实验。最后,我们又推向了临床试验,并最终获得审批。
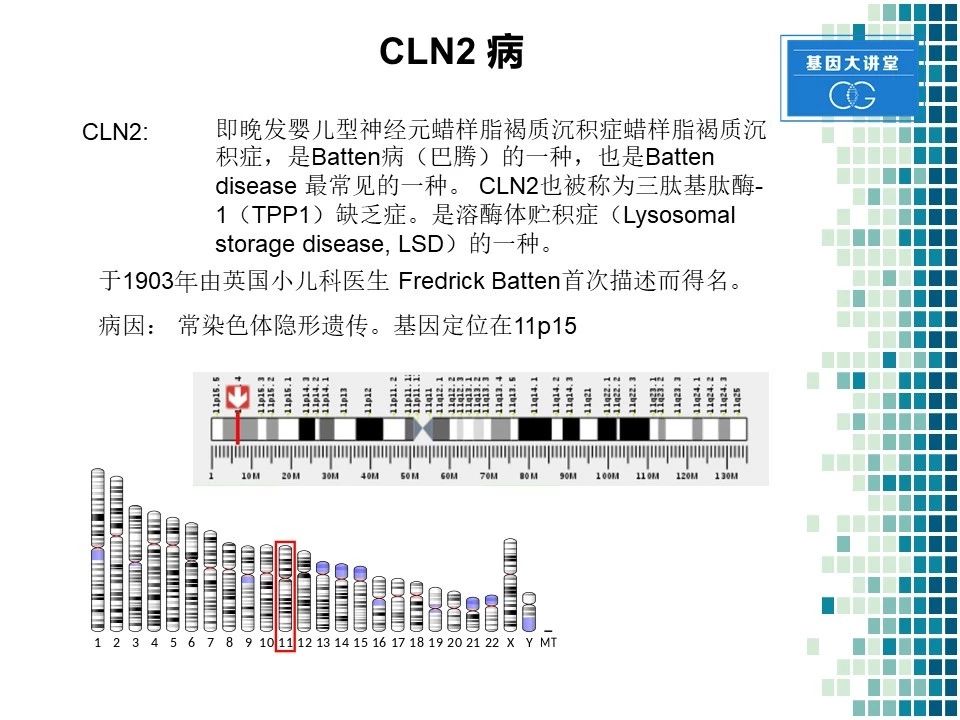
我们首先来看一下什么是CLN2。CLN2是巴腾病的一种亚型,也是该病最常见的一种亚型。它还有另一个名字叫做三肽基肽酶一缺乏症。该病于1903年,第一次由英国小儿科医生Batten描述而得名。该病是常染色体隐性遗传,其基因位于第11号染色体短臂的15位点。

其病因比较明确。主要是由于三肽基肽酶1,也就是TPP1的缺乏。由于TPP1的缺乏导致细胞不能正常降解脂褐素,造成脂褐素在各种细胞内的沉积。随后引发神经元的死亡和脱失,当大量神经元死亡时就会出现一定的临床症状,这个病的发病年龄通常是在4到10岁,平均发病年龄在五岁左右。由于视网膜的视神经比较敏感且不能进行功能代偿,所以一般首发症状为快速的视力恶化和眼底视网膜变性,同时也伴随着其它症状,比如癫痫、脑电波异常、运动障碍、智力退化、语言障碍和认知水平的改变。如做CT和核磁成像,会显示在疾病后期有大脑萎缩和一定程度的小脑萎缩。诊断主要是通过几个方面:第一通过实验室检查,进行电子显微镜超微结构的检查,可以发现细胞内有洋葱样颗粒的沉积,第二根据临床诊断,比如视觉的丧失,认知运动功能的障碍和癫痫,最终的确诊靠CLN2基因突变和TPP1酶的活性检测。

这是这个酶的三维结构,研发的内部代号是 BMN 190。合成办法是利用中国仓鼠卵巢细胞的细胞系(CHO)进行合成,随后过柱子进行纯化。这张图是我们最后商品化的药物。整个药物的研发过程,可以分为以下几个部分,酶合成, 细胞实验,动物模型和临床试验。
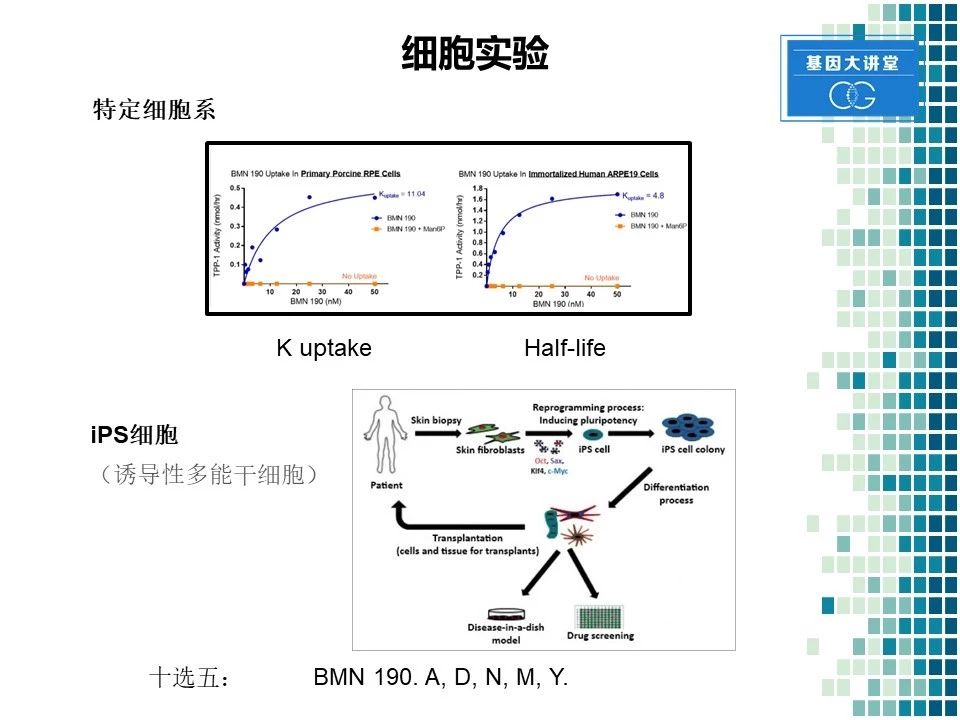
在完成酶的合成以后,我们首先得进行细胞实验。细胞实验又分为两部分,第一,没有特定的细胞系来进行验证这个合成酶的摄取情况,以及它的半衰期。我们发现了这种酶还是可以有效的被细胞摄取,同时半衰期在12天左右,所以这是一种非常有效且稳定的一种酶。同时我们利用诱导性多能干细胞进行了进一步验证,进行体外验证这种酶的疗效。诱导性多能干细胞最近被广泛用于药物研究,具体方法是从获取病人的皮肤细胞,随后经过进一步的转化,成为多能干细胞。然后通过定向诱导分化成为神经元细胞进行培养,从而进一步的进行药物筛选。我们一开始的时候总共合成了十个酶。通过进行细胞筛选,我们最终选出了五个,进行下一步的实验。

我们采用的第一个动物模型是基因敲除小鼠。这种小鼠会在七周左右出现类似于CLN2病人的一些症状,比如说是震颤、癫痫、共济失调等。其生存期为20周,140天左右。我们知道正常实验大小鼠一般的生存期在一年到两年左右,所以其寿命相对于正常小鼠来讲显著缩短。这种酶是一种大分子,很难通过血脑屏障,所以我们采用侧脑室注射的方法来给药。给药这张图显示的是我们的注射系统。这张图是显示的动物在置管以后能够完全恢复,并不对动物本身有什么负面影响,这张图上显示的是动物在接受药物输入的时候的情况。
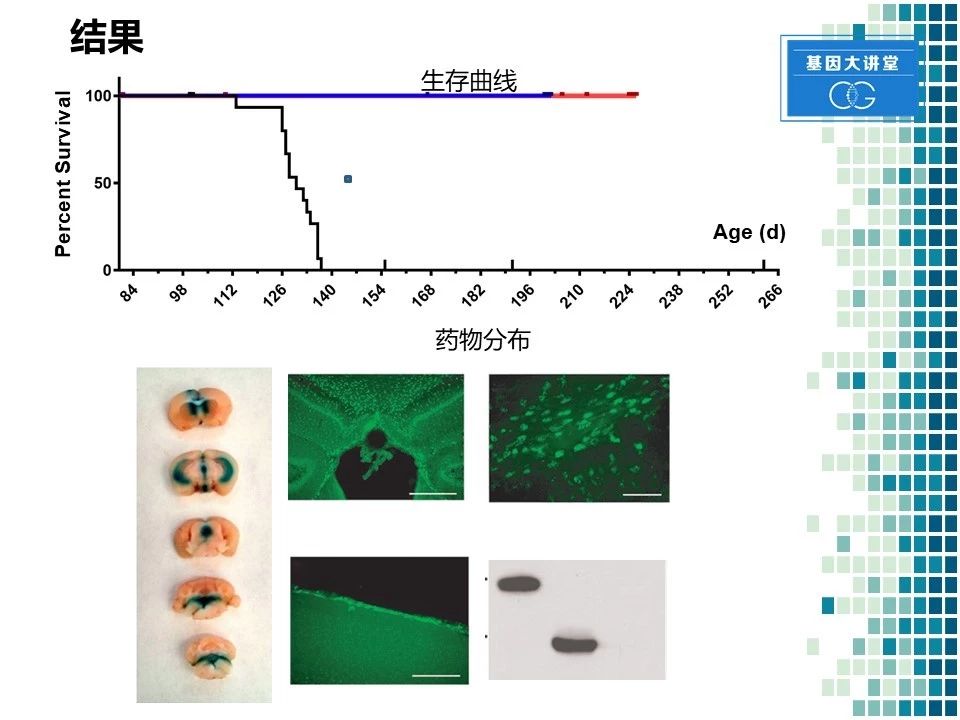
那我们先来看一下结果。我们采用每两周给药,我们做了一些前期实验,发现两周给药一次是最为理想的给药频率。所以在随后的实验中,我们都采用了此类方法。我们发现通过每两周给药一次以后显著的延长了小鼠生存期,从140天延长到250天左右。同时我们也取了一部分小鼠的大脑,进行染色观察。我们发现这种药物在大脑内分布较好。比如在海马,胼胝体,大脑皮层表面上都有显著的良好的分布。同时,我们在小鼠输入药物以后进行大脑匀浆蛋白测定。测到了这种酶的存在,进一步确认了侧脑室给药是完全可行的一种给药方法。当然我们也进行了一系列的行为学实验和形态学检查,在此就不详细展开了。

通过这一系列的实验,我们发现以下几个结果:侧脑室注射是一种非常稳定有效的给药路径。在给药频率方面,每两周给药一次,能够达到最好的效果。 当给药剂量为25微克/5微升的时候,药物就显著降低了各种炎性指标,提高了神经元的存活数,而且小鼠在行为学上也产生了显著的改善。药物分布方面,该药物在大部分脑组织中均有分布。同时在整个过程中,我们也发现了一些不良反应,最主要是药物沉淀以及输液管阻塞。随后我们进行了一系列修改,通过改善它的缓冲液成分,解决了这个问题,避免了将来在临床实验中可能出现的一些问题。而且通过小鼠实验,我们对候选药物进行了进一步的优化,从五种候选药物中发现了BMN190.A是在生产以及疗效方面是最优秀的,所以在后面的大型动物实验中,我们就采用了这一个药物。

另一个非常重要的动物实验是犬的实验。我们采用的动物模型的是长毛腊肠犬。采用此类动物的最主要的原因是这类动物有TPP1突变型,其症状和病人临床症状非常相似。这张图片显示病变动物的脑组织染色,在大脑皮层和小脑部位均出现了脂褐素沉积,给予TPP1显著的擅长动物的生存期,而且呈现一定的剂量依赖性。
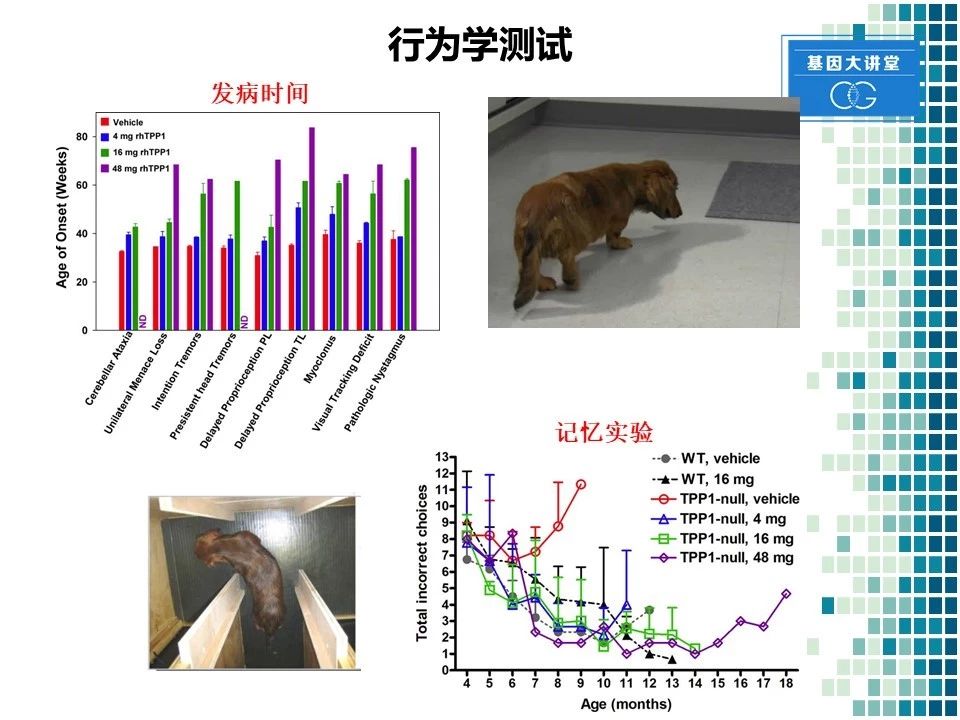
对于这些动物,我们也进行了一些行为学的测试。比如发现通过采用注射该药物以后,动物的发病时间显著推迟。同时我们还进行了动物的记忆实验。我们将食物放在迷宫中不同的格子里面。然后训练动物记忆食物的位置,之后观察动物的记忆能力。结果发现该药物在不同的剂量上,均能显著改善动物的记忆能力,降低其错误次数。
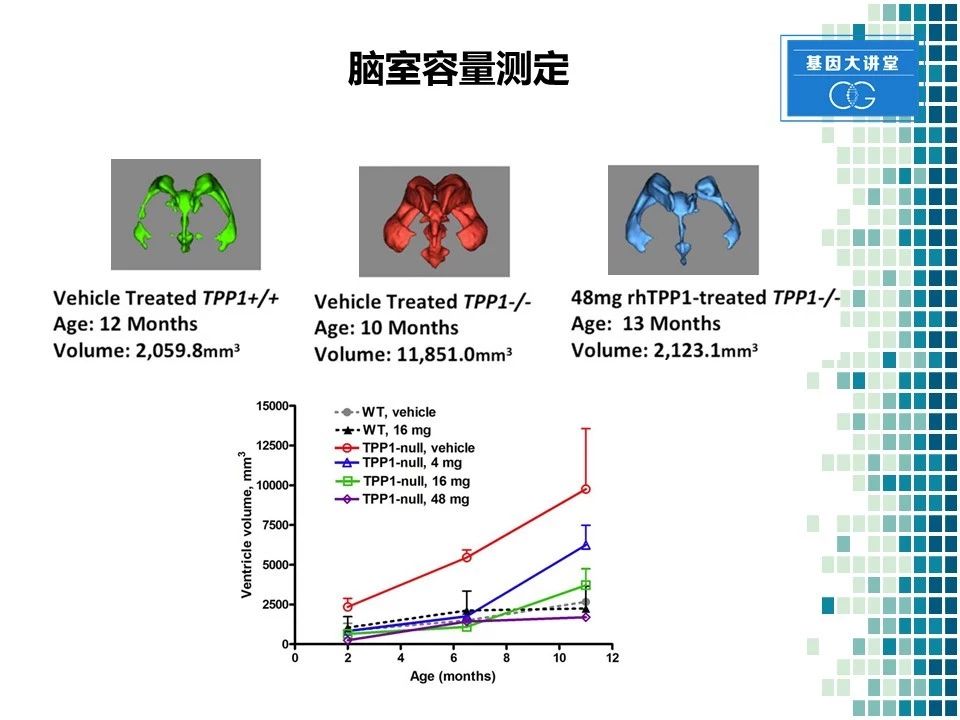
最后我们还对动物的脑室体积进行了测定,左边这张图显示的是正常动物脑室体积在2000立方毫米左右。而对于发病动物,由于神经元坏死导致的大脑皮层的萎缩,脑室容量显著增加,达到了11000立方毫米左右,几乎是正常动物的6倍。右边这张图显示的是经过治疗后的动物,在13月的时候脑室体积,为2000立方毫米左右,几乎降低到了正常动物的水平。随后的统计学分析也表明采用TPP1处理可以显著降低脑室容量,也就是说改善了大脑萎缩的情况。总之,TPP1这个药物在小鼠,以及犬的疾病模型中均得到了充分的验证。
随后我们还做了一系列的研究,其中包括对小鼠模型的反复研究,以及对犬类模型的安全试验等,以及最终在食蟹猴身上进行的测试。我们又进行了一系列的临床实验,最终完成了所有数据的采集,并且进行了申报。

在去年人类重组酶的药物,获得了FDA和欧盟的批准并且成功上市。但是从2009年首次研发开始到最后的上市,中间间隔八年的时间,所以这个新药的研发过程还是比较长的。在此基础上,我们公司还申请了侧脑室注射装置的一项专利。这是我们在药物上市以后,第一位小病人接受治疗时候的情况。此外,关于临床实验的实验结果,最终于今年发表在新英格兰医学杂志上面。
但是,酶替代疗法也有很多问题。以TPP1为例,它的问题就在于,第一它需要终身服药,患者需要每两周接受一次药物注射,而且每次药物的注射时间比较长,达到八个小时左右,所以对于活泼好动的儿童来讲,这一点是非常不方便的。另外就像我们前面所提到的,因为作为罕见病的价格都比较昂贵。对于这个药来讲,每两周病人需花费27000美元,每年的花费在70万美元左右,考虑到病人可能需要终身服药,因此每个病人的花费可能要达到几百万美元甚至上千万美元。所以,我们也希望通过一些基因疗法来进一步改善这个问题。关于基因疗法,如果有机会的话,我在下一次的讲座中,可以谈到这个问题。

好,谢谢大家关注,祝大家工作顺利!
Part-3
问答环节
观众a:
谢谢巩老师的报告,请问基因疗法相对于ERT,有哪些优缺点?
巩克瑞老师:
我们首先来谈一下优点。第一,基因疗法在某种程度上能一劳永逸,一次注射效果可以维持几年甚至终身。第二,痛苦少,基因疗法都是采用静脉注射,相比一些药物需要特殊的方法来注射,基因疗法的痛苦会少很多。比如前面提到的药物采用的是侧脑室注射,需要做脑部手术,而且每次注射需要八个小时,时间比较长。基因治疗大多采用静脉注射,相对来说时间就会短很多。
基因疗法的缺点有以下几点。第一,药厂考虑到利润的问题,所以基因疗法的定价会比ERT更贵。据我所知,基因疗法的定价在一百万美元左右。第二,基因疗法不能适用于所有的病人,能否采用基因疗法取决于这个病人是否对已知病毒有抗体反应。如果这个病人对已知病毒有明显的抗体,或者有免疫反应,就不能采用这种疗法。比如首次因为基因疗法而死亡的病人Jesse Gelsinger,就是因为机体出现过强免疫反应,导致多脏器衰竭而死亡。第三,不是所有的病都适合基因疗法,目前基因疗法采用的病毒大部分是AAV,如果有些病的致病基因比较长,不能够被包裹到AAV里面,就不能采用基因疗法。
当然展开来讲,优缺点不仅限于这些,我挑了几个比较重要的说明了一下。
观众b:
国内目前有基因疗法吗?
巩克瑞老师:
其实如果大家检索一下信息就会发现,基因疗法早在2003年就被我国批准过,而且是世界上第一例批准的基因疗法,当时是针对P53基因所做的基因疗法。但实际上这个疗法当时根本就没有做三期临床实验,也没有得到FDA审批。所以,这家公司(我就不透露名字了),可能都快要倒闭了。目前来讲,国内还没有正式开展的基因疗法,可能有些临床试验在进行。
观众c:
巩博您好,请问我国孤儿药的发展前景如何?
巩克瑞老师:
我认为我国孤儿药还是有很好的发展前景的。就像我前面提到的,孤儿药的门槛不是特别高,相对来讲,技术研发不是很困难,对于我国来讲更容易突破。最近几年,我国的生物技术和生物制药方面,取得了长足的进展,研发孤儿药应该不存在太大的技术难度。从政策上我们也能看到,国家近些年来扶持力度逐渐增大。从世界的角度来看,其它国家也非常重视孤儿药的开发,这对我们国家来讲都是利好消息。
目前来讲,其实我国已经有几个公司,他们所研制的药物已经获得FDA批准,用于治疗某些常见病的罕见类型或者表型。但是我国相对其它国家来讲,无论是在立法,还是财政支持方面,都还有些差距。对于我国病人来讲,由于医疗保险或者其它综合因素的问题,负担还是比较大的。总之,前途是光明的,道路是曲折的。
观众d:
巩老师您好,基因疗法是不是也需要收集变异信息?比如变异类型、占比等?
巩克瑞老师:
谢谢您的问题。我主要负责前期药物开发,不是很了解临床病人适应症,但是我觉得要看针对什么样的病症。如果是癌症类型的病人,肯定要收集变异类型,并希望最终能实现个体化治疗。但是对于体内代谢酶类缺乏的病人,基因变异不是制约因素。
观众e:
您好巩博,请问酶替代疗法药物研发的主要难点有哪些?
巩克瑞老师:
这个问题我觉得可以从两个方面来回答。第一个方面是前期的研发。最主要的问题在于如何合成一个能够被机体所接受,并且能被细胞充分摄取的酶。我们在研发过程中就会发现有些酶,虽然体外试验效果很好,但是体内注射的时候疗效并不是很好。另一个问题我觉得还是在临床实验方面,要找到足够多的病人参与临床试验。还有,我们发现有些酶,不管是体外还是体内实验,效果都特别好,但最大的问题是合成起来特别困难。所以最终选择药物后产物的时候,要综合各方面进行考虑。
第二个方面还是临床实验方面。就像前面所提到的,病人的数量要达到5000左右,对药厂来讲,才相对具有研发的价值。但是大部分罕见病人不能得到及时的诊断,病人的数目依赖于医生的诊断水平。对于研发企业来讲,不能尽快找到受试者是个很大的问题,所以企业和临床医师(key opinion leader, KOL)的合作与交流非常重要。个人和临床医生交流的感受就是我国潜在的罕见病病人数量很大,罕见病数目很多,但是大多需要去一线城市进行诊断,所以相对来讲,发现的罕见病病人就不是很多。
观众f:
请问使用基因技术来治疗罕见病,在未来多少年有望得以实现?
巩克瑞老师:
对于罕见病的基因治疗,目前已经有大量文献发表,其效果均得到了有效验证。在病人方面,也有很多临床I期实验在进行。比如血友病A型(HemophiliaA)已经有几家公司(Spark,Sangomo,Biomarin)在进行临床试验,而且有些公司已经给出了让人非常激动的试验结果。比如Biomarin最近发表的结果显示:单次基因注射已经让绝大部分病人摆脱了对凝血因子的依赖,显著降低了出血概率,而且没有观察到较大的不良反应。所以,未来5年内,甚至更快就会实现基因疗法在广大罕见病病人身上的应用。


