Oxidation Resistance 1(OXR1) 基因是含 TLDc 结构域家族的高度保守基因, 参与基本的生物和细胞过程, 包括 DNA 损伤反应、抗氧化途径、细胞周期、神经元保护和精氨酸甲基化。OXR1在氧化应激抗性中起着重要作用,但不直接在活性氧(ROS)清除中起作用,也不具有过氧化氢酶或超氧化物歧化酶活性。大脑中代谢率较高,抗氧化能力相对较低,因此大脑更容易受到ROS水平不平衡的影响。2019年有研究报道来自三个家庭的 5 名携带 OXR1 突变的患者表现出小脑萎缩等表型。然而, OXR1对人脑细胞功能和分子机制的影响在很大程度上是未知的。目前仍没有相关疾病模型来探索 OXR1 缺乏的病理影响。
2023年9月,挪威奥斯陆大学的研究人员发表论文“A loss-of-function mutation in human Oxidation Resistance 1 disrupts the spatial–temporal regulation of histone arginine methylation in neurodevelopment”,报道了人类OXR1基因TLDc结构域的一种新的功能缺失突变,临床表型为早发性癫痫、发育迟缓、认知障碍和小脑萎缩。研究人员通过构建患者来源的诱导多能干细胞(iPSC),揭示了神经分化受损以及神经发育关键基因的失调。OXR1通过激活蛋白质精氨酸甲基转移酶(PRMT)来影响组蛋白精氨酸的甲基化,继而调节基因表达。研究人员进一步构建了患者iPSC诱导的脑类器官,发现OXR1有助于特定脑区组蛋白精氨酸甲基化的时空调节。
临床发现
研究人员通过全外显子组测序筛选出OXR1基因位于c端TLDc结构域的供体剪接位点突变(XM_005250993.1: c.2552 + 5G > C)。患者临床表现为发育延迟、伴有局灶性肌阵挛运动、活动障碍、认知障碍和癫痫发作。磁共振成像发现患者小脑萎缩,脑胼胝体变薄。对患者II-4成纤维细胞进行RT-PCR及测序发现突变体OXR1片段较短,表明OXR1突变引起Exon18跳跃,导致OXR1 c端TLDc结构域69个氨基酸缺失。Western blot实验显示患者细胞中OXR1蛋白缺失,表明Exon18跳跃导致蛋白不稳定。(图1)
图1 OXR1基因供体剪接位点突变导致外显子跳跃和蛋白质缺失
体外细胞模型研究
研究人员通过免疫共沉淀(Co-IP)实验证明了OXR1与PRMT5以及PRMT1在U-2OS细胞中的相互作用,且在人成纤维细胞中通过原位邻近连接实验进一步验证这一结果(图2a)。PRMT可以通过催化组蛋白H3和H4(例如H3R2、H3R17和H4R3)N末端的组蛋白(H)精氨酸(R)甲基化来激活或抑制基因表达。研究人员检测了iPSC分化为神经干细胞过程中的组蛋白修饰,发现对照NSCs中H3R2/R17、H4R3、H3K4/K9/K27上组蛋白甲基化增加(图2b)。体外甲基化测定实验证明,全长OXR1和包含TLDc结构域部分截短的OXR1A突变体(OXR1A_∆TLDc_1)催化的甲基化水平为单PRMT5催化三倍。缺乏TLDc结构域的OXR1A突变体(OXR1A_ΔTLDc_2)未能促进PRMT5活性(图2c)。这一结果表明OXR1的TLDc结构域可能在PRMT催化的H4R3甲基化的调节中发挥作用。
图2 OXR1在神经发生过程中调节PRMT诱导的表观遗传组蛋白修饰
iPSC模型研究
研究人员从患者II-4的成纤维细胞和健康对照中生成iPSC。结果发现OXR1ΔEx18 iPSCs在核型、多能性标记物表达水平及定向分化能力上均与对照组无差异(图3d-f)。
图3 OXR1ΔEx18iPSCs鉴定结果
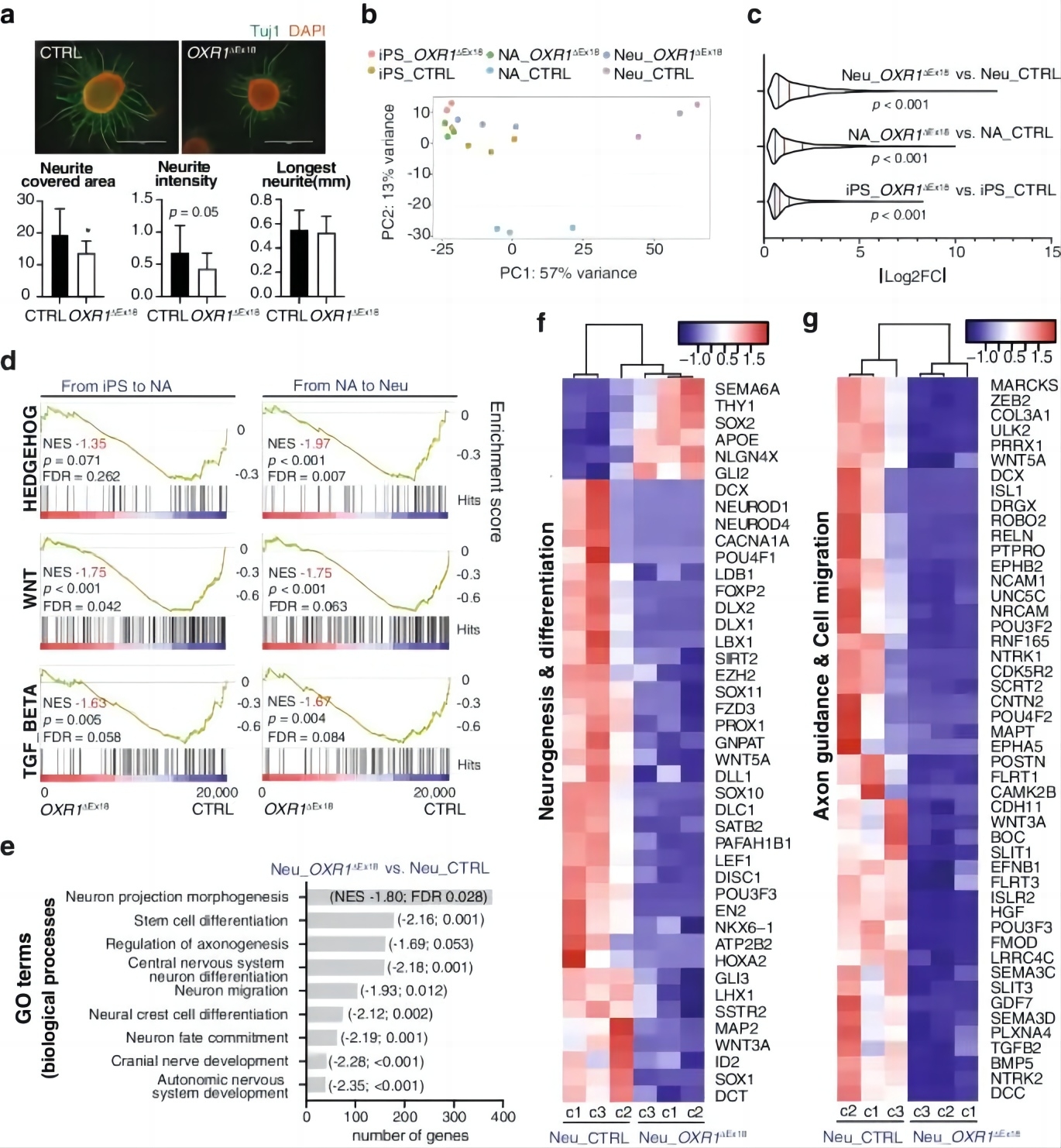
将两组iPSC诱导成神经元后,发现OXR1缺乏会导致神经元的数量减少并抑制神经突生长(图4a)。为阐明OXR1对神经分化转录网络的调节作用,研究人员通过对对照和OXR1ΔEx18两组iPSCs的神经元分化过程的三个不同阶段(iPSCs、NAs和神经元)进行转录组分析,发现对照iPSCs、NAs和神经元三个克隆的转录组显示出不同的聚类,表明发育阶段存在明确的、阶段特异性的神经分化过程。相反,在OXR1ΔEx18细胞分化阶段之间没有观察到显著的聚集(图4b,c)。通过基因集富集分析(GSEA)进行的通路富集显示,在对照组中参与神经发育的核心通路如Hedgehog、WNT和TGF-β被激活,但在OXR1ΔEx18中没有被激活(图4d)。GO分析显示,Neu-OXR1ΔEx18与对照神经元的差异表达基因富集于神经发育过程(图4e)。此外,Neu-OXR1ΔEx18中神经发生和神经分化以及轴突引导和细胞迁移所必需的基因显著下调(图4f-g)。这些结果揭示了OXR1影响神经元分化过程中的基因转录过程。
器官类模型研究
研究者随后从对照和OXR1ΔEx18 iPSCs中生成了皮质类器官(图5a)。对照皮质类器官包含由SOX2标记的放射状组织的脑室区/室下区(VZ/SVZ)样结构,OXR1ΔEx18皮质类器官显示出VZ/SVZ样结构形态异常(图5b)。由CTIP2和Ki67标记的早期出生神经元也显示OXR1ΔEx18组皮质类器官发育落后(图6c)。研究报道,OXR1可以与精氨酸甲基转移酶PRMT5相互作用,并介导组蛋白修饰H3R2me2s从而调控转录,OXR1的存在可以增强其甲基转移酶能力(Yang et al, Cell Rep., 2020; PMID: 32209476)。研究者通过免疫荧光发现对照皮质类器官中H4R3me2s标记存在特定分布,其随着VZ/SVZ样结构在径向迁移后的发育神经元中呈现增加水平。而在OXR1ΔEx18皮质类器官中H4R3me2s分布水平总体降低(图5d)。在OXR1ΔEx18皮质类器官中,PRMT5的另一个靶标H3R2me2s,其水平也出现总体下降(图5e)。这些结果表明,OXR1通过调控组蛋白精氨酸甲基化影响人类早期皮质发生。
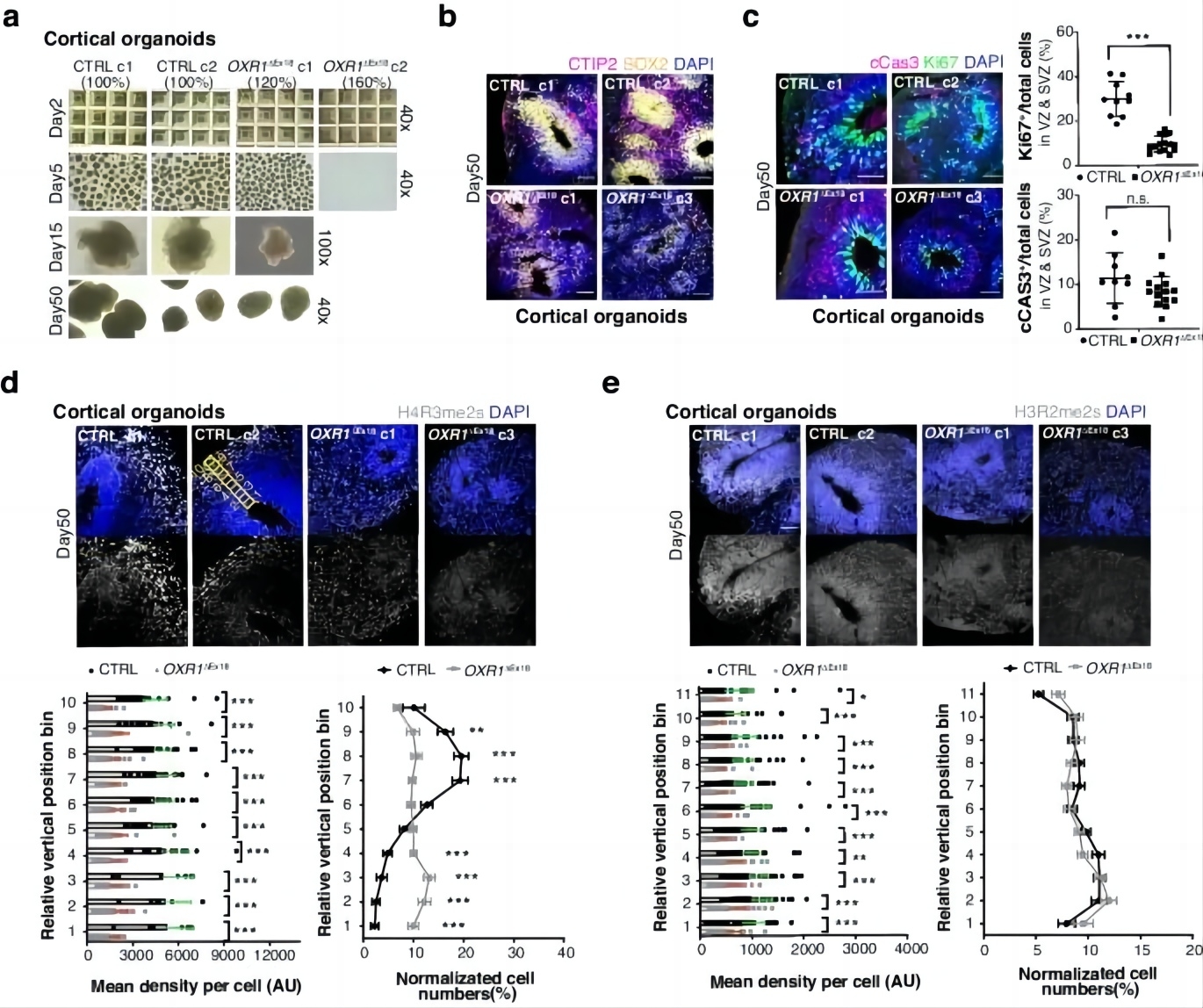
图5 OXR1通过调控组蛋白精氨酸甲基化来影响皮层发育
总 结
综上,研究者利用全外显子组测序、RT-PCR和WB鉴定了患者致病突变基因OXR1。通过体外实验和iPSC诱导的细胞模型对OXR1在细胞存活和神经分化中的作用做了进一步的探究。研究发现OXR1ΔEx18 iPSC的神经分化过程中NPC增殖、神经元命运规范、轴突形成和神经元迁移均受到了影响。此外,这一研究还揭示了OXR1通过调节PRMT催化的组蛋白精氨酸甲基化在早期人脑发育的表观遗传学调控中的重要作用。这项研究为OXR1缺乏症的致病机制提供了新的见解。
原文链接:https://genomebiology.biomedcentral.com/articles/10.1186/s13059-023-03037-1#Sec12
赛福in vitro 功能验证平台针对临床常见突变类型,提前终止、剪切变异及错义变异,提供从分子到细胞水平的基因功能验证解决方案。通过获取患者血液或组织样本, 或建立细胞过表达模型/iPSC 模型,针对基因表达产物进行全方位定量,定位和定性检测,以验证变异位点的致病性


