文献速递|GEMIN5基因功能丧失突变导致神经发育障碍

2021年5月7日美国匹兹堡大学医学中心Udai Bhan Pandey团队在Nature communications发表了题为“Loss of function mutations in GEMIN5 cause a neurodevelopmental disorder”的论文。GEMIN5是一种RNA结合蛋白,是SMN复合体的组成部分,促进小核核糖核蛋白(snRNPs)的组装,参与mRNA剪接。该研究收集了30例发育迟缓和小脑共济失调的患者,发现均含有GEMIN5基因双等位变异。通过一系列实验发现该基因的突变可影响snRNPs复合物组装,并导致发育缺陷、运动功能障碍。该研究结果为GEMIN5双等位基因变异与神经发育迟缓和共济失调综合征提供了关联性证据。
双等位基因GEMIN5变异导致运动为主的发育迟缓和小脑萎缩
该研究通过GeneMatcher汇集了22个不相关家庭的30例患者。他们表现为发育迟缓、张力减退和小脑共济失调,并在出生后2年内确诊。虽然大多数患者存在认知和语言迟缓,但主要是运动迟缓。患者4、5和6(family 3和4)出生时表现为严重的张力减退,被诊断为SMA,其他大多数患者不符合SMA的经典表型(图a)。30例患者中有23例出现中枢性张力低下,所有可行走的患者均有步态共济失调。所有患者的脑MRI显示小脑萎缩(图d-j)。研究者们在GEMIN5中鉴定了30种变异,其中4种功能丧失变异,22种错义变异(图s2)。所有的变异均发生在进化保守碱基,在gnomAD中是罕见的或没有收录的,多款软件预测这些错义变异是致病性的或有害的。
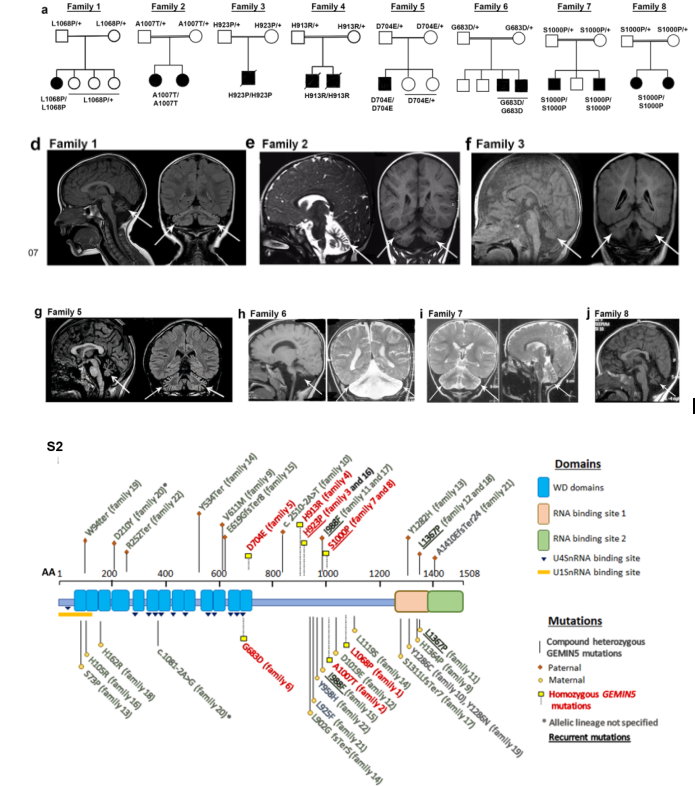
图1 30例患者的GEMIN5基因的变异分布及部分家系图和MRI示例
Leu1068Pro,His913Arg两种致病变异可导致GEMIN5和snRNP复合物蛋白表达丢失。
研究者从患者1(Leu1068Pro/Leu1068Pro)和未受影响的亲本携带者(Leu1068Pro/+)获得的单个核细胞并诱导多能干细胞系(iPSC)。用CRISPR/Cas9构建了His913Arg/His913Arg纯合及His913Arg/+杂合iPSC系。通过免疫荧光,发现GEMIN5在两种纯合子变异神经元细胞的胞质分布显著减少,而杂合变异体的神经元显示GEMIN5细胞核-胞质分布正常(图a-e)。同时也检测了snRNPs复合蛋白(SMN, GEMIN2,GEMIN4和GEMIN6)。观察到GEMIN2在纯合子His913Arg和Leu1068Pro神经元中分布模式与GEMIN5相似(图f)。两变异纯合子神经元的GEMIN2水平也只在细胞质中显著减少(g-j)。

图2 携带His913Arg和Leu1068Pro GEMIN5变异的iPSC来源神经元细胞中SMN组装蛋白的差异表达
然后,研究者们检测了GEMIN5变异对GEMIN5及其SMN复合体的相互作用分子蛋白的表达水平影响。发现Leu1068Pro和His913Arg变异使GEMIN5蛋白水平减少了70 ~ 80%,也使GEMIN4,GEMIN3, GEMIN2, GEMIN6, SMN, U1A蛋白表达水平降低(图3a-3d)。又通过qPCR实验检测GEMIN5 mRNA的表达,发现纯合子和对照组之间的转录水平没有显著差异(图3p,3q)。但在Leu1068Pro纯合子神经元中,GEMIN5 mRNA的半衰期为1.872,而在杂合子中则为2.559。提示纯合子变异中GEMIN5蛋白的减少是由于其mRNA和蛋白质稳定性的差异,而非转录失调(图3r)。

图3 GEMIN5两错义变异降低了GEMIN5和SMN组装蛋白的水平
内源性敲低GEMIN5会破坏snRNP蛋白复合物,出现发育迟缓和运动功能障碍。
研究者选用两种shRNA抵抗GEMIN5,转染到HEK293T细胞,并评估SMN复合体蛋白的水平。结果显示GEMIN5的降低显著影响SMN, GEMIN4, GEMIN3, GEMIN6, GEMIN2的表达(图4a-i)。还采用RNAi技术将果蝇中GEMIN5的同源物敲低,与对照组相比,RNAi组出现蛹致死和羽化缺陷,提示有严重的发育缺陷,幼虫肌肉神经接点明显减小,成虫的攀爬能力也明显降低(图4j-o)。同时监测了两组果蝇45天的存活情况,发现33天后RNAi组果蝇死亡率为100%,而对照组死亡率为19%(图4p)。GEMIN5敲低导致果蝇运动功能障碍和寿命缩短,与GEMIN5患者中发现的神经症状相同。

图4 GEMIN5的缺失对snRNP复合物和果蝇发育的影响
与SMA患者的神经元相比,GEMIN5患者的神经元具有独特的转录组特征
研究者又对GEMIN5H913RiPSC神经元进行了RNA-seq分析,并与已发表的SMA (SMN1Ex7del)患者iPSC神经元数据集进行了比较。与SMN1Ex7del患者的神经元相比,GEMIN5H913中有大量下调的基因(图5a, b)。鉴定出GEMIN5H913和SMN1Ex7del l特有的1278和3004个转录本,而这两种疾病条件下共有622个转录本(图5c)。但通过对SMN1Ex7del和GEMIN5H913中常见的前40个DEGs的热图分级聚类比较,显示出了相反的表达趋势,表明这两种疾病导致了不同的转录组改变(图6d)。
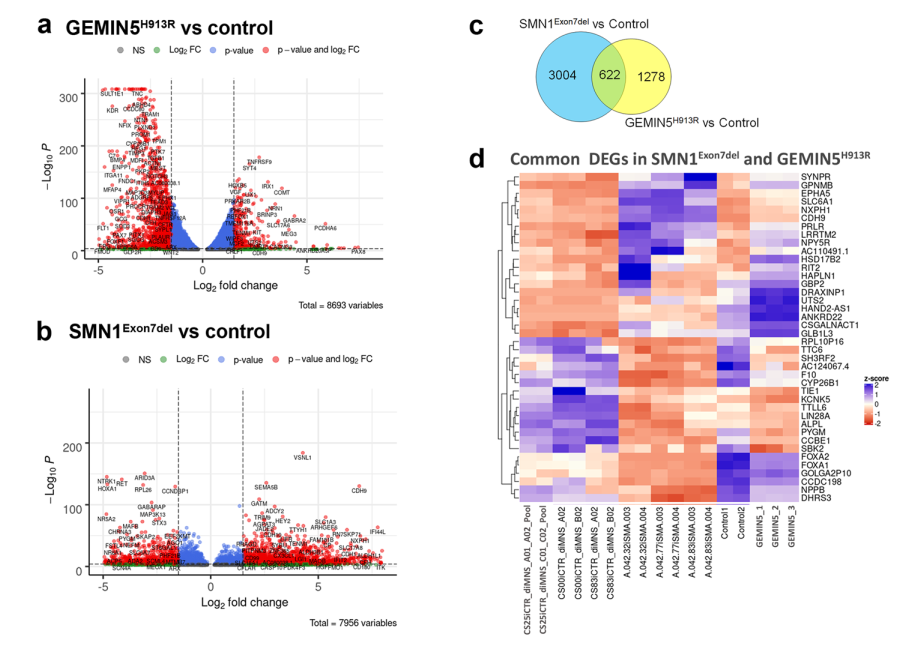
图5 GEMIN5和SMA患者iPSC神经元RNA-seq分析结果
赛福说
该团队首次发现GEMIN5双等位基因变异,可导致发育迟缓、运动功能障碍和小脑萎缩,还会影响snRNP复合物组装蛋白。遗憾的是,可能由于患者的临床和突变的异质性,未进行表型和基因型相关的研究。赛福基因协助临床通过数据深度挖掘发现GEMIN5双等位基因变异(即文中两例患者及4种变异类型),助力潜在致病新基因发现,帮助患者找到病因。


